Objectif
Étudier la vitesse d'une réaction chimique et les facteurs qui l'influencent.
Pourquoi c'est important ?
- Permet de contrôler et optimiser des réactions e

Annales

Annales

Annales

Annales

Annales

Annales

Annales
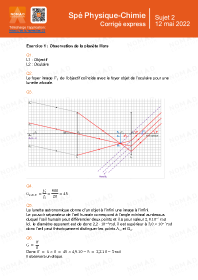
Annales

Annales

Annales
Étudier la vitesse d'une réaction chimique et les facteurs qui l'influencent.

Les piles – Équilibre chimique 1

Les piles – Équilibre chimique 2

Les piles – Équilibre chimique 3

Les piles – Équilibre chimique 4

Tableau d’avancement

Méthode tracés des vecteurs vitesse et accélération

Transferts thermiques

Transformations en chimie organique

Formulaire de Physique – Ondes et signaux

Mécanique
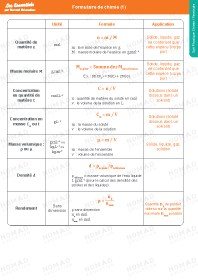
Formulaire de Chimie

Fiche outils
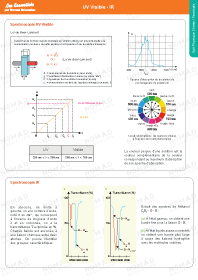
UV Visible - IR

Groupes caractéristiques

Mesures et incertitudes

Lunette astonomique - Dipôle RC
Quand le réactif limitant ne disparaît pas entièrement, la transformation n'est pas totale.
Le taux d'avancement final (à l'équilibre) est sans unité et s'exprime par $$\tau = \frac{x_f}{x_{\rm max}}$$ où $x_f$ et $x_{\rm max}$ sont en mol.
Le quotient de réaction est une grandeur (sans unité) qui permet de connaître l'état d'avancement d'une réaction chimique. Le quotient d'une réaction $\rm aA + bB = cC + dD$ est défini tel que :
$$\boxed{Q_r = \rm \frac{[C]^c \cdot [D]^d}{[A]^a \cdot [B]^b}}$$
Les concentrations $\rm [A]$ sont en $\bf mol.L^{-1}$ et $Q_r$ n'a pas d'unité. Si $\rm X$ est un solide ou de l'eau, on remplace $\rm [X]$ par 1.
Le quotient de réaction à l'état final $Q_{r,f}$ est appelé constante d'équilibre de la réaction $\rm K$. Chaque réaction a sa propre constante d'équilibre, notée $\bf K$.
$$\boxed{\mathrm K = Q_{r,\rm éq} = \rm \frac{[C]^c_{éq} \cdot [D]^d_{éq}}{[A]^a_{éq} \cdot [B]^b_{éq}}}$$
