Objectif
Comprendre ce qu'étudie la thermodynamique et connaître les grandeurs et principes fondamentaux.
Pourquoi c'est important ?
- Permet de compren

Thermodynamique 1

Thermodynamique 2

Thermodynamique 3

Thermodynamique 4

Annales

Annales

Annales

Annales
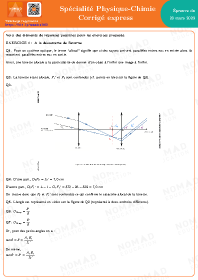
Annales

Annales

Annales

Annales

Annales

Annales
Comprendre ce qu'étudie la thermodynamique et connaître les grandeurs et principes fondamentaux.
Le gaz parfait est un modèle simplifié des gaz. Dans ce modèle on suppose que toutes les interactions entre les molécules sont négligeables (à l'exception des chocs).
$\boxed{\rm P \cdot V = n\cdot R\cdot T}$
Avec :
$\rm P$ en pascal (Pa)
$\rm V$ en mètre cube $\rm (m^3)$
$\rm T$ en Kelvin (K)
$\rm n$ en mole (mol)
$\rm R$ est la constante des gaz parfaits ($\rm R = 8,314\: SI$)
La température est une grandeur physique universelle. Cette mesure s'effectue avec un thermomètre gradué en degrés Celsius (noté °C). Il existe d'autres unités de mesure : le degré Kelvin.
$\boxed{\rm °C = K - 273}$
L'énergie interne $\rm U$ d'un système macroscopique est égale à la somme de :
$\boxed {\rm U = E_c (micro) + E_p (micro)}$
Il existe 2 modes de transferts de l'énergie :
Un système est dit isolé s'il n'effectue pas de transferts d'énergie avec d'autres systèmes. Dans ce cas, son énergie totale $\rm (E_{totale} = E_m + U)$ se conserve.
La variation de l'énergie totale d'un système au cours d'une évolution est égale à la somme des travaux des forces extérieures $\rm W$ et des transferts thermiques $\rm Q$ échangés avec le milieu extérieur :
$\boxed {\rm \Delta E_{totale} = \Delta E_m + \Delta U = W + Q}$
Par convention, les transferts d'énergie sont positifs si reçus par le système et négatifs si cédés par le système au milieu extérieur.
Si un système ne subit pas de modification de son mouvement et de son altitude, alors son énergie mécanique ne varie pas, et dans ce cas :
$\boxed {\rm \Delta E_{totale} = \Delta U = W + Q}$ avec $\rm \Delta U$, $\rm W$ et $\rm Q$ en $\rm J$
Pour un système incompressible de masse $\rm m$ et de capacité thermique massique $\rm c$ dont la température varie :
$\boxed {\rm \Delta U_{i \to f} = m \times c \times (T_f – T_i)}$ avec $\rm \Delta U_{i \to f}$ en $\rm J$, $\rm m$ en $\rm kg$, $\rm c$ en $\rm J.kg^{-1}.K^{-1}$ et $\rm T$ en $\rm K$.

Tableau d’avancement

Méthode tracés des vecteurs vitesse et accélération

Transferts thermiques

Transformations en chimie organique

Formulaire de Physique – Ondes et signaux

Mécanique
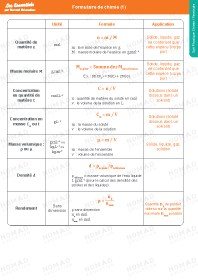
Formulaire de Chimie

Fiche outils
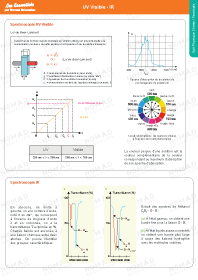
UV Visible - IR

Groupes caractéristiques

Mesures et incertitudes

Lunette astonomique - Dipôle RC