Objectif
Déterminer la concentration d'une espèce chimique dans une solution par des méthodes expérimentales précises.
Déterminer la concentration d'une espèce chimique dans une solution par des méthodes expérimentales précises.
Comprendre le fonctionnement d'une pile, savoir l'écrire avec les demi-équations et calculer sa tension.
Un titrage conductimétrique ne peut être effectué que si la réaction du titrage fait intervenir des ions.

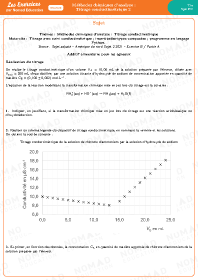
Dans tous les cas, ces deux droites se coupent en un point correspondant au changement de pente de la courbe. Ce point représente l'équivalence. On lit alors son abscisse pour obtenir le volume équivalent $\rm V_E$.
$\scriptstyle\color{limegreen}{\boxed{\color{black}{\scriptstyle\sigma = \sum\limits_i^n\scriptstyle\lambda_i \times [\mathrm X_i]}}}\color{balck}{\scriptstyle\left| \begin{array}{lll}\scriptstyle\sigma : \text{ conductivité en }\rm S.m^{-1}\\
\scriptstyle\lambda : \text{ conductivité ionique molaire } \rm S.m^2.mol^{-1}\\
\scriptstyle\rm [X] : \text{ concentration ionique en } \color{limegreen}{mol.m^{-3}}\\
\color{limegreen}{\scriptstyle\rm(attention)}\end{array}\right.}$

$\color{black}{\rm V_B}$ |
$\color{black}{\rm [H_3O^+]}$ |
$\color{black}{\rm [Cl^-]}$ |
$\color{black}{\rm [Na^+]}$ |
$\color{black}{\rm [HO^-]}$ |
$\color{black}{\rm V_B < V_E}$ |
diminue |
constant |
augmente |
$\color{black}{\approx 0}$ |
$\color{black}{\rm V_B > V_E}$ |
$\color{black}{\approx 0}$ |
constant |
augmente |
augmente |
Conductivités molaires ioniques $\lambda$ de quelques ions à $\rm 25°C$
| Ion | $\lambda$ (en $mS.m^2.mol^{-1}$) |
| $\color{black}{\rm Na^+}$ | $\color{black}{5,0}$ |
| $\color{black}{\rm HO^-}$ | $\color{black}{19,9}$ |
| $\color{black}{\rm H_3O^+}$ | $\color{black}{35,0}$ |
| $\color{black}{\rm Cl^-}$ | $\color{black}{7,6}$ |
Avant l'équivalence, la courbe est une droite de pente négative car $\rm \lambda H_3O^+ > \lambda Na^+$. De même, après l'équivalence, la courbe est une droite de pente positive car les $\rm Na^+$ et $\rm HO^-$ s'accumulent dans le bécher.
Le titre massique en pourcent ou pourcentage massique noté $\rm P_m(E)$ d'une espèce $\rm E$ dans un liquide est donné par $\displaystyle \rm\frac{m(E)}{m_{totale}}$ avec $\rm m(E)$ masse de l'espèce $\rm E$ et $\rm m_{totale}$ masse totale du liquide exprimées dans la même unité.
$\displaystyle \rm P_m (E) = \frac{m(E)}{m_{totale}}$
On peut identifier un corps pur grâce à :

Tableau d’avancement

Méthode tracés des vecteurs vitesse et accélération

Transferts thermiques

Transformations en chimie organique

Formulaire de Physique – Ondes et signaux

Mécanique
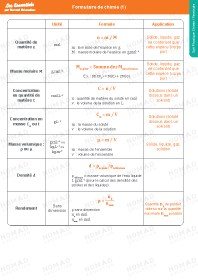
Formulaire de Chimie

Fiche outils
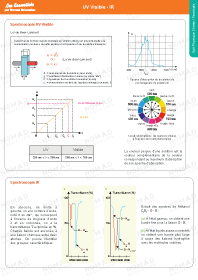
UV Visible - IR

Groupes caractéristiques

Mesures et incertitudes

Lunette astonomique - Dipôle RC

Annales

Annales

Annales

Annales
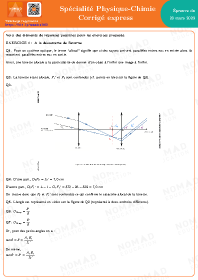
Annales

Annales

Annales
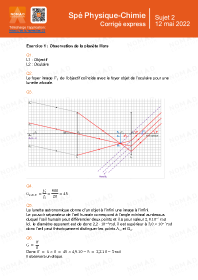
Annales

Annales

Annales

Méthodes chimiques d’analyse : Titrage conductimétrique 1
Méthodes chimiques d'analyse : Titrage conductimétrique 2

Méthodes chimiques d'analyse : Titrage conductimétrique 3

Méthodes chimiques d'analyse : Titrage conductimétrique 4