Objectif
Étudier la vitesse d'une réaction chimique et les facteurs qui l'influencent.
Pourquoi c'est important ?
- Permet de contrôler et optimiser des réactions e
Étudier la vitesse d'une réaction chimique et les facteurs qui l'influencent.

Annales

Annales

Annales

Annales

Annales

Annales

Annales

Annales

Annales

Annales
Les alcanes non cycliques ont pour formule générale $\rm C_nH_{2n+2}$. Le nom des alcanes linéaires prend la terminaison –ane. Un préfixe indique le nombre d'atomes de carbone dans la chaîne carbonée.

Pour les alcanes ramifiés : Rechercher la chaîne principale : chaîne carbonée la plus longue. Cette chaîne termine le nom et est nommée comme l'alcane linéaire précédemment. Repérer les ramifications (groupes alkyles) sur cette chaîne. On utilise les mêmes préfixes en fonction du nombre de C de chaque ramification mais avec la terminaison –yl. On numérote la chaîne principale afin que les C portant les ramifications aient les plus petits chiffres possibles. On nomme la molécule en précédant le nom de la chaîne principale par celui des groupes alkyles dans l'ordre alphabétique précédés de leur position sur la chaîne et d'un préfixe multiplicatif (di-, tri-, tétra-) si besoin.

Les alcènes possèdent une double liaison $\rm C=C$ et leur formule est $\rm C_nH_{2n}$ s'ils sont non cycliques. On remplace –ane par –ène précédé de la position du $\rm C$ de la double liaison et on ajoute $\rm Z$ ou $\rm E$.

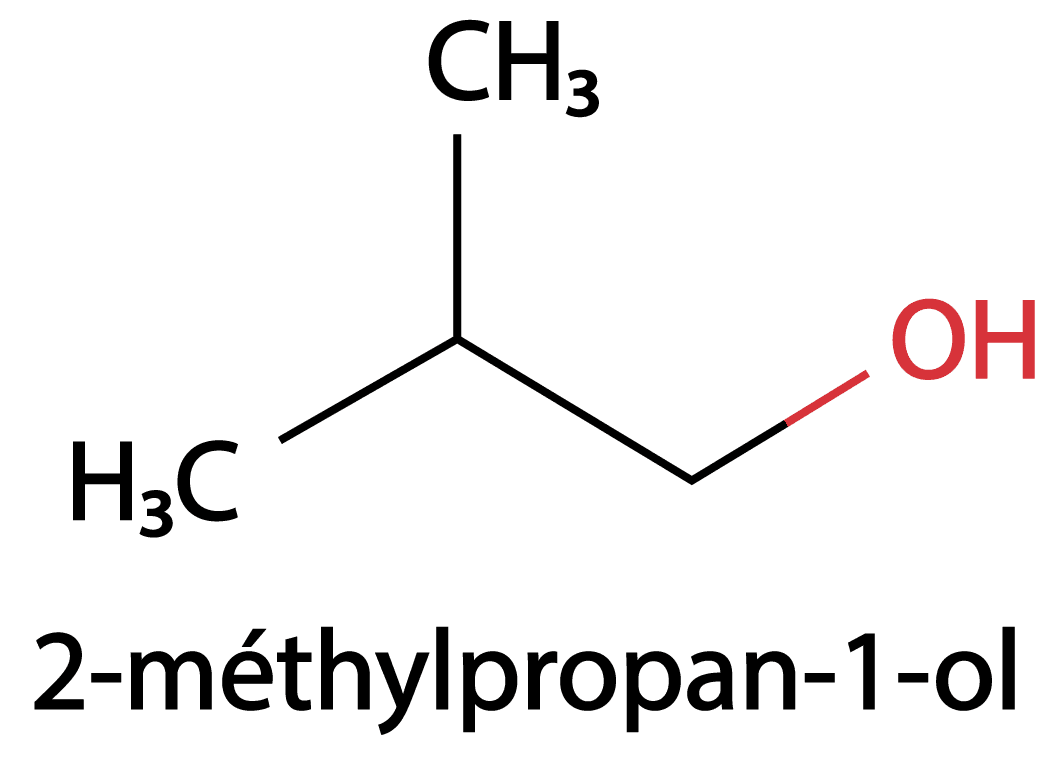
Les alcools sont des molécules comportant le groupe hydroxyle $\rm –OH$. On ajoute –ol à la terminaison –ane précédée de la position du $\rm C$ fonctionnel.
Les composés carbonylés possèdent le groupe carbonyle

Chez les aldéhydes, il se trouve en bout de chaîne carbonée, au contraire des cétones. On remplace –ane par –al pour les aldéhydes et par –one pour les cétones précédé de la position du $\rm C$ fonctionnel.

Les acides carboxyliques possèdent le groupe carboxyle
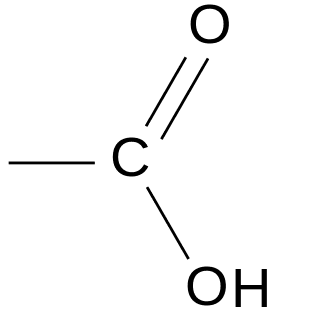
On ajoute –oïque à la terminaison -ane et on précède le nom par le mot acide.

Les esters possèdent le groupe ester

Leur nom est en deux parties : la chaîne carbonée contenant le groupe ester prend la terminaison « –oate de » suivi du nom du groupe alkyle lié à l'atome $\rm O$.

Les amines possèdent le groupe amino $\rm NH_2$. L'atome $\rm N$ peut être lié à $0$, $1$ ou $2$ $\rm H$. Aux plus simples (contenant $\rm –NH_2$), on ajoute –amine à la terminaison -an précédé de la position la plus petite possible du groupe. Aux autres, on précède le nom par la mention $\rm N-alkyl$ correspondant aux groupes liés à $\rm N$.

Les amides possèdent le groupe amide
 .
.
L'atome $\rm N$ est relié à $0,1$ ou $2$ $\rm H$. Le nom des amides les plus simples, contenant $\rm –NH_2$, dérive de celui de l'acide carboxylique, en supprimant « acide » et en remplaçant –oïque par –amide.
Exemplebutanamide

Deux molécules sont isomères si elles possèdent la même formule brute mais un arrangement d'atomes différents. Ces molécules isomères n'auront pas les mêmes propriétés physico-chimiques.
On différencie plusieurs types d'isomérie :
le butane (chaîne linéaire) et le méthylpropane (chaîne ramifiée) ont la même formule brute $\rm C_4H_{10}$.
Le butane : $\scriptstyle \rm CH_3\quad – \quad CH_2 \quad – \quad CH_2 \quad – \quad CH_3$
Le méthylpropane : $\begin{array}{ccc}\scriptstyle \rm CH_3 & \scriptstyle – & \scriptstyle \rm CH & & \scriptstyle – & \scriptstyle\rm CH_3\\ & & | \\& & \scriptstyle\rm CH_3\end{array}$
Le propan-1ol : $\begin{array}{ccc}\scriptstyle \rm CH_2 & \scriptstyle – & \scriptstyle \rm CH_2 & \scriptstyle – & \scriptstyle \rm CH_3\\ | \\ \scriptstyle \rm OH \end{array}$
Le propan-2-ol : $\begin{array}{ccc}\scriptstyle \rm CH_2 & \scriptstyle – & \scriptstyle \rm CH_2 & \scriptstyle – & \scriptstyle \rm CH_3\\ & & | \\ & & \scriptstyle \rm OH \end{array}$
Le butanone : $\begin{array}{ccc}\scriptstyle \rm CH_3 & \scriptstyle – & \scriptstyle \rm C & \scriptstyle – & \scriptstyle \rm CH_2 & \scriptstyle \rm CH_3\\ & & \| \\ & & \scriptstyle \rm O \end{array}$
Le butanal : $\scriptstyle \rm CH_3\quad – \quad CH_2 \quad – \quad CH_2 \quad – \quad CH \quad = \quad O$

Tableau d’avancement

Méthode tracés des vecteurs vitesse et accélération

Transferts thermiques

Transformations en chimie organique

Formulaire de Physique – Ondes et signaux

Mécanique
Formulaire de Chimie

Fiche outils
UV Visible - IR

Groupes caractéristiques

Mesures et incertitudes

Lunette astonomique - Dipôle RC