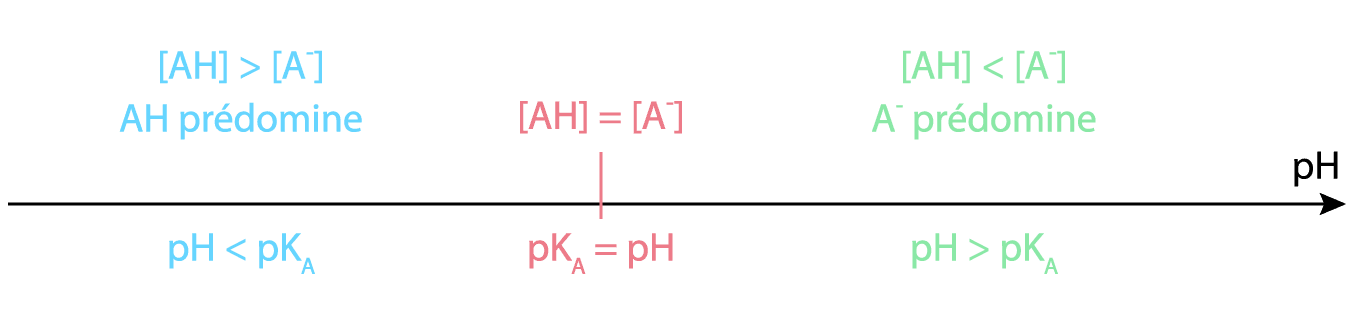Objectif
Comprendre la définition d'un acide et d'une base, reconnaître une réaction acido-basique, et savoir l'écrire et l'équilibrer.

Tableau d’avancement

Méthode tracés des vecteurs vitesse et accélération

Transferts thermiques

Transformations en chimie organique

Formulaire de Physique – Ondes et signaux

Mécanique
Formulaire de Chimie

Fiche outils
UV Visible - IR

Groupes caractéristiques

Mesures et incertitudes

Lunette astonomique - Dipôle RC

Transformations acide-base et pH - Force des acides et des bases 1

Transformations acide-base et pH - Force des acides et des bases 2

Transformations acide-base et pH - Force des acides et des bases 3

Transformations acide-base et pH - Force des acides et des bases 4

Transformations acide-base et pH - Force des acides et des bases 5
Comprendre la définition d'un acide et d'une base, reconnaître une réaction acido-basique, et savoir l'écrire et l'équilibrer.
Comprendre ce qu'est une réaction d'oxydo-réduction, savoir identifier oxydant et réducteur, et équilibrer les équations.

Annales

Annales
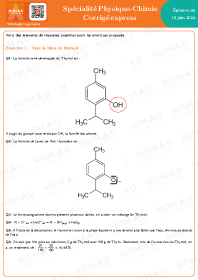
Annales

Annales
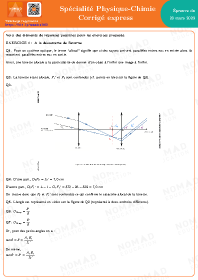
Annales

Annales

Annales

Annales

Annales

Annales
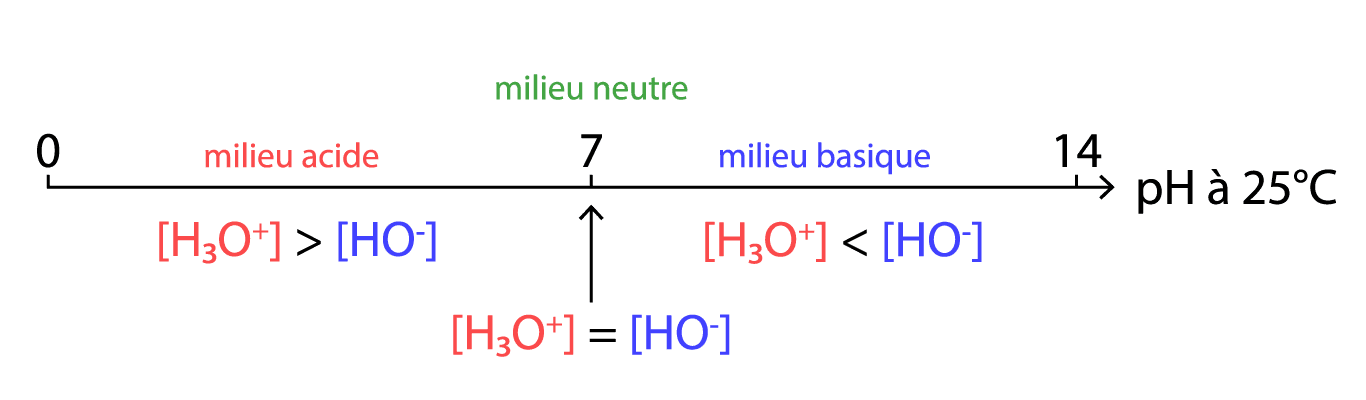
La constante d'équilibre de la réaction d'autoprotolyse de l'eau est appelée produit ionique de l'eau et notée $\rm Ke$.
$\rm \color{green}{H_2O(I)} \color{blue}{~+~} \color{red}{H_2O(I)} \color{blue}{~=~} \color{green}{H_3O^+_{(aq)}} \color{blue}{~+~} \color{red}{HO^-_{(aq)}}$
$\color{red}{\boxed{\begin{array}{ll}\color{black}{\rm Ke = [H_3O^+]_{éq} \times [HO^-]_{éq}}\\
\color{black}{\rm Ke= \color{red}{10^{-14}} \color{black}{\text{ à 25°C}}}\\
\color{black}{\rm \Rightarrow pKe = -\log (Ke) = \color{red}{14}}.\end{array}}}$
Un acide fort $\rm AH$ réagit totalement avec l'eau. Ces réactions sont caractérisées par une flèche simple entre les réactifs et les produits.
$\rm AH_{(aq)} + H_2O \rightarrow A^-_{(aq)} + H_3O^+_{(aq)}$
Une base forte $\bf A^-$ réagit également totalement avec l'eau.
Calcul du pH :
Un acide faible $\rm AH$ ne réagit pas totalement avec l'eau. Une base faible $\rm A^-$ ne réagit pas totalement avec l'eau non plus.
$\rm AH_{(aq)} + H_2O \leftrightarrows A^-_{(aq)} + H_3O^+_{(aq)}$
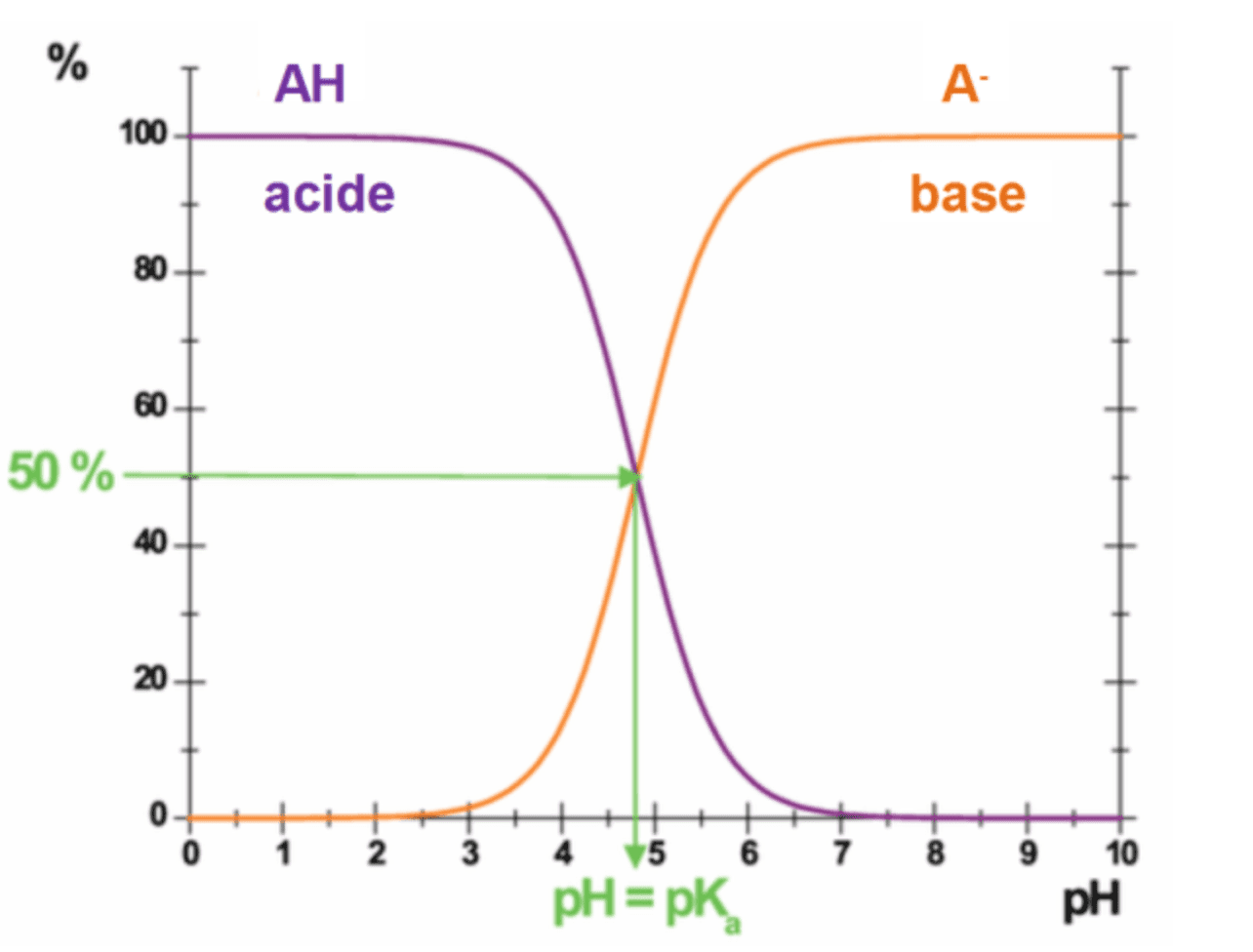
Chaque couple acide faible / base faible est caractérisé par une grandeur sans dimension nommée constante d'acidité, notée $\bf K_A$, du couple $\rm AH / A^-$ :
$\displaystyle \rm K_A = \frac{[H_3O^+]_{eq}\cdot [A^-]_{eq}}{[AH]_{eq}}$ avec $\color{plum}{\boxed{\begin{array}{ll}\color{black}{\text{[Concentration] en } \rm mol.L^{-1}}\\
\color{black}{\rm K_A \text{ sans dimension}}\end{array}}}$
$\rm pK_A = -\log K_A$ et $\rm K_A = 10^{-pK_A}$
Une solution tampon a un pH qui varie peu par addition d'une petite quantité d'acide ou de base, et par dilution modérée.