Objectif
Définir ce qu'est une onde, connaître ses grandeurs caractéristiques, et savoir utiliser les formules de base pour les calculs.
Définir ce qu'est une onde, connaître ses grandeurs caractéristiques, et savoir utiliser les formules de base pour les calculs.
La concentration C en quantité de matière (en $\rm mol.L^{-1}$) d'une espèce chimique en solution est le quotient de la quantité de matière $n$ de soluté (en $\rm mol$) par le volume $\rm V_{solution}$ de la solution :
$$\mathrm C = \frac{n}{\rm V_{solution}}$$
La concentration en masse $\rm C_m$ de soluté (en $\rm g.L^{-1}$) s'obtient par la relation : $\rm C_m = C \times M$ avec $\rm M$ masse molaire en $\rm g.mol^{-1}$.
On peut préparer une solution par :
On calcule la masse de solide à dissoudre pour préparer une solution de concentration $\rm C$ et de volume $\rm V_{solution}$ avec :
$m = n \times \rm M = C \times V_{solution} \times M$
Au cours d'une dilution, la quantité de matière de soluté prélevée dans la solution mère $\rm n_{mère}$ est égale à la quantité de matière présente dans la solution fille $\rm n_{fille}$. On écrit $\rm n_{mère} = n_{fille}$ donc :
$\rm C_{mère} \times V_{mère} = C_{fille} \times V_{fille}$
On définit le facteur de dilution $\rm F$ par :
$$\rm F = \frac{C_{mère}}{C_{fille}}$$
Le spectre de la lumière blanche est continu avec des radiations comprises entre $380$ et $\rm 780~ nm$.
L'absorbance $\rm A$ (sans unité) d'une solution est une grandeur qui caractérise la capacité d'une solution colorée à absorber une partie de la lumière qui la traverse pour une longueur d'onde $\lambda$ donnée. On mesure l'absorbance $\rm A$ d'une solution à l'aide d'une cuve placée dans un spectrophotomètre. On mesure $\rm A$ pour chaque longueur d'onde du visible et on trace $\mathrm A = f(\lambda)$. On obtient par exemple :
Le spectre d'absorption de la solution présente un maximum pour $\rm\lambda = 530~nm$. La couleur de la solution est donc la couleur complémentaire sur le cercle chromatique, soit magenta.
Pour une longueur d'onde $\lambda$ donnée, l'absorbance d'une solution diluée de concentration $\rm C$ en espèce chimique colorée est donnée par la loi de Beer-Lambert :
$$\rm A = \epsilon \times \mathcal l \times C$$
avec :
On écrit souvent $\mathrm A = k \times \rm C$ (relation de proportionnalité entre l'absorbance et la concentration d'une solution donc $\mathrm A = f(\rm C)$ donne une droite passant par l'origine.
Un dosage par étalonnage permet de déterminer la concentration en espèce chimique dans une solution en comparant son absorbance à celles de solutions étalons contenant la même espèce chimique et étant obtenues à partir de la dilution d'une solution mère de concentration connue. On mesure $\rm A$ de la gamme étalon obtenue, puis on trace $\mathrm A = f(\rm C)$. On mesure l'absorbance de la solution à doser. Grâce à la courbe d'étalonnage, on lit la concentration de l'espèce chimique.

Sujet zéro 1 – Le 2,5-diméthylfurane : un carburant d’avenir ?

Sujet zéro 2 – La correction de l'hypermétropie

Sujet zéro 3 – Les ions ferreux essentiels pour le transports du dioxygène dans le sang

Spé Physique-Chimie

Mesures et incertitudes

Fiches Outils

Estimer les incertitudes de mesures

Vecteurs vitesse et variation de vitesse

Formulaire de chimie

Spectroscopie UV-visible

Formulaire de physique – Mouvement et interactions

Nommer les molécules organiques

Réactions d'oxydo-réduction

Formulaire de physique – Énergie-Ondes et signaux

Loi de Beer-Lambert 1

Loi de Beer-Lambert 2

Loi de Beer-Lambert 3

Loi de Beer-Lambert 4

Oxydo-réduction 1

Oxydo-réduction 2

Oxydo-réduction 3

Oxydo-réduction 4

Titrage 1

Titrage 2

Titrage 3

Titrage 4

Polarité et solubilité 1

Polarité et solubilité 2

Polarité et solubilité 3

Polarité et solubilité 4
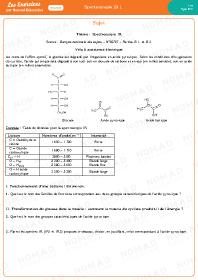
Spectroscopie IR 1

Spectroscopie IR 2
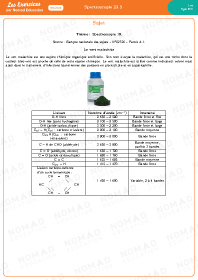
Spectroscopie IR 3
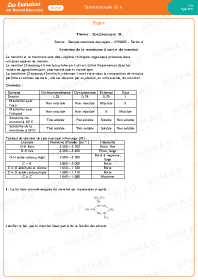
Spectroscopie IR 4

Combustions 1

Combustions 2
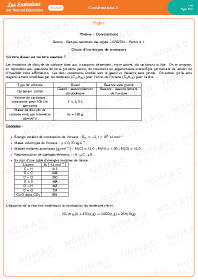
Combustions 3

Combustions 4

Sujet zéro 2 – La correction de l'hypermétropie

Sujet zéro 3 – Les ions ferreux essentiels pour le transports du dioxygène dans le sang

Sujet zéro 1 – Le 2,5-diméthylfurane : un carburant d’avenir ?