Objectif
Connaître la structure de l'atome, les notions de numéro atomique et de masse, et comprendre la différence entre isotopes, ions et atomes neutres.
Connaître la structure de l'atome, les notions de numéro atomique et de masse, et comprendre la différence entre isotopes, ions et atomes neutres.

Loi de Beer-Lambert 1

Loi de Beer-Lambert 2

Loi de Beer-Lambert 3

Loi de Beer-Lambert 4

Oxydo-réduction 1

Oxydo-réduction 2

Oxydo-réduction 3

Oxydo-réduction 4

Titrage 1

Titrage 2

Titrage 3

Titrage 4

Polarité et solubilité 1

Polarité et solubilité 2

Polarité et solubilité 3

Polarité et solubilité 4
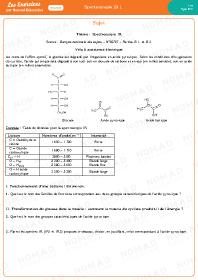
Spectroscopie IR 1

Spectroscopie IR 2
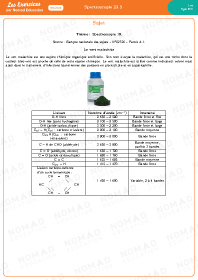
Spectroscopie IR 3
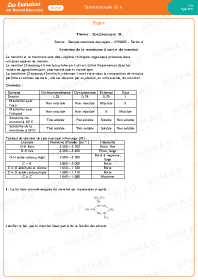
Spectroscopie IR 4

Combustions 1

Combustions 2
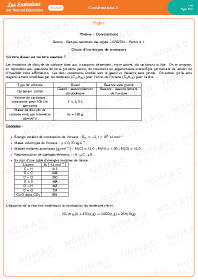
Combustions 3

Combustions 4
Un solide ionique est constitué de cations et d'anions régulièrement disposés dans l'espace. Il est électriquement neutre. La cohésion d'un solide ionique est assurée par les interactions électrostatiques attractives entre les charges opposées, donc entre les cations (ions positifs) et les anions (ions négatifs).
Un solide moléculaire est constitué d'un empilement régulier et ordonné de molécules dans l'espace. La cohésion d'un solide moléculaire est assurée par :

Un solvant polaire, comme l'eau, est constitué de molécules polaires.
Un solvant apolaire, comme le cyclohexane, est constitué de molécules apolaires.
Les solides ioniques sont solubles dans les solvants polaires, ils sont solubles dans l'eau par établissement d'interactions électrostatiques attractives entre les charges des ions du soluté et les charges partielles des molécules d'eau.
Les solutés moléculaires polaires sont solubles dans les solvants polaires.
L'équation de dissolution d'un solide ionique $\mathrm{A}y\mathrm{B}x\mathrm {(s)}$ dans l'eau s'écrit :
$\rm A_{\mathcal y}B_{\mathcal x}(s) \rightarrow \mathcal y A^{\mathcal x+} (aq) + \mathcal x B^{\mathcal y-} (aq)$
La concentration en quantité de matière des ions $\mathrm A^{x+}$ et $\mathrm B^{y-}$ est :
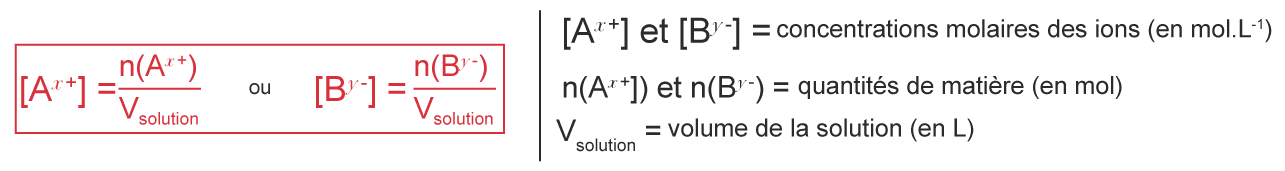
L'extraction liquide-liquide consiste à extraire une espèce présente dans un solvant S1 par un autre solvant $\rm S_2$. Ce solvant $\rm S_2$ est non miscible avec $\rm S_1$, l'espèce à extraire y est plus soluble que dans $\rm S_1$ et il respecte les règles de sécurité et d'environnement. Pour procéder à l'extraction, on utilise une ampoule à décanter.

Certaines espèces chimiques, amphiphiles, sont constituées de 2 parties :
Ces espèces amphiphiles sont des tensioactifs et expliquent les propriétés lavantes des savons.



Spé Physique-Chimie

Mesures et incertitudes

Fiches Outils

Estimer les incertitudes de mesures

Vecteurs vitesse et variation de vitesse

Formulaire de chimie

Spectroscopie UV-visible

Formulaire de physique – Mouvement et interactions

Nommer les molécules organiques

Réactions d'oxydo-réduction

Formulaire de physique – Énergie-Ondes et signaux

Sujet zéro 1 – Le 2,5-diméthylfurane : un carburant d’avenir ?

Sujet zéro 2 – La correction de l'hypermétropie

Sujet zéro 3 – Les ions ferreux essentiels pour le transports du dioxygène dans le sang

Sujet zéro 3 – Les ions ferreux essentiels pour le transports du dioxygène dans le sang

Sujet zéro 2 – La correction de l'hypermétropie

Sujet zéro 1 – Le 2,5-diméthylfurane : un carburant d’avenir ?