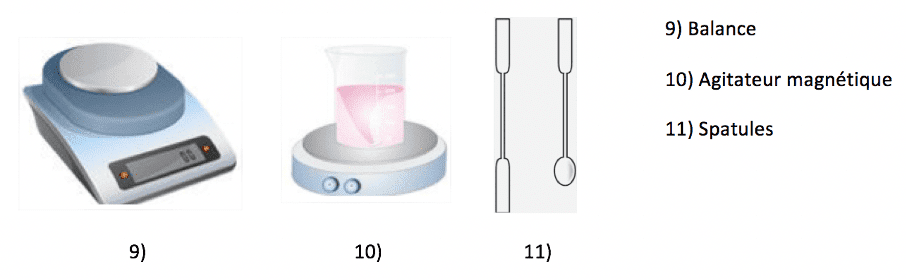
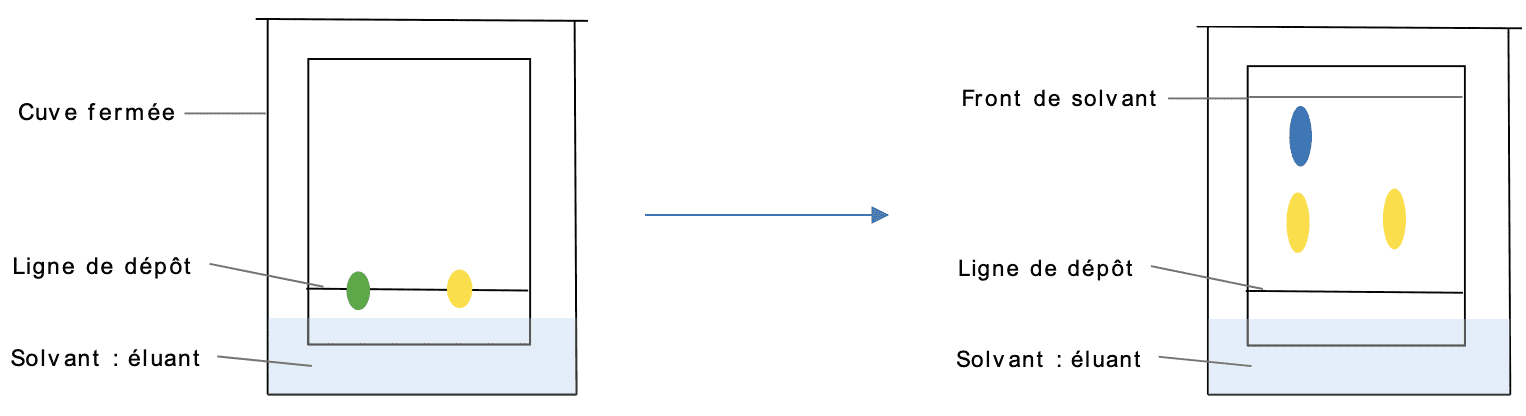
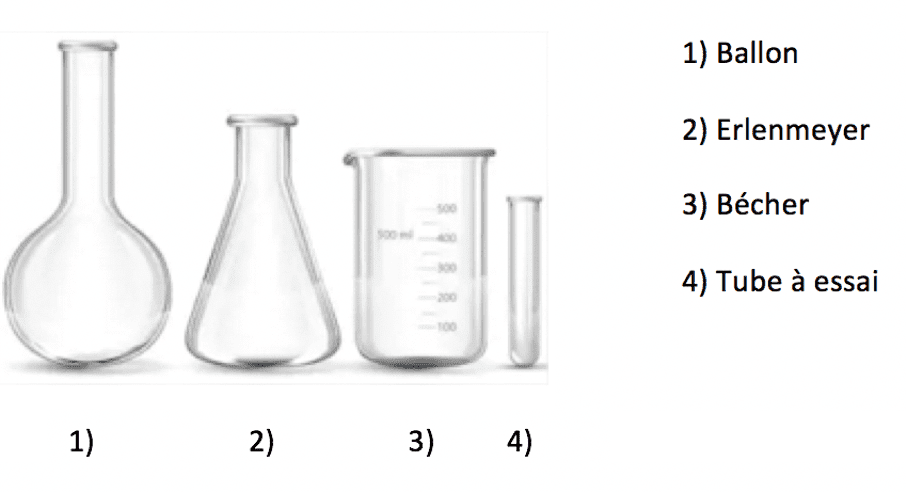Composition des liquides et structure atomique
Composition des liquides
Les liquides contiennent des molécules, souvent différentes, qui sont elles-mêmes formées d'atomes de différents éléments, ainsi que d'ions.
Structure de l'atome
Un atome est un élément chimique formé d'un noyau autour duquel des électrons orbitent.
Composition du noyau
Le noyau contient des protons, qui portent chacun une charge électrique positive, et des neutrons qui ne portent pas de charge électrique. Protons et neutrons forment les nucléons.
Propriétés électriques de l'atome
Les électrons portent chacun une charge électrique, de même valeur que celle portée par le proton, mais de signe opposé. L'atome étant électriquement neutre, il contient autant de charges positives que négatives : il possède donc autant de protons que d'électrons.
Organisation des électrons
Les électrons se répartissent sur des couches électroniques, notées $\rm K$, $\rm L$, $\rm M$…, autour du noyau atomique, la couche $\rm K$ étant la couche la plus proche du noyau.