Concentration en quantité de matière
La concentration C en quantité de matière (en $\rm mol.L^{-1}$) d'une espèce chimique en solution est le quotient de la quantité de matière $n$ de soluté (en $\rm mol$) par le volume $\rm V_{solution}$ de la solution :
$$\mathrm C = \frac{n}{\rm V_{solution}}$$
Concentration en masse
La concentration en masse $\rm C_m$ de soluté (en $\rm g.L^{-1}$) s'obtient par la relation : $\rm C_m = C \times M$ avec $\rm M$ masse molaire en $\rm g.mol^{-1}$.
Préparation d'une solution
On peut préparer une solution par :
Dissolution
On calcule la masse de solide à dissoudre pour préparer une solution de concentration $\rm C$ et de volume $\rm V_{solution}$ avec :
$m = n \times \rm M = C \times V_{solution} \times M$
Dilution
Au cours d'une dilution, la quantité de matière de soluté prélevée dans la solution mère $\rm n_{mère}$ est égale à la quantité de matière présente dans la solution fille $\rm n_{fille}$. On écrit $\rm n_{mère} = n_{fille}$ donc :
$\rm C_{mère} \times V_{mère} = C_{fille} \times V_{fille}$
On définit le facteur de dilution $\rm F$ par :
$$\rm F = \frac{C_{mère}}{C_{fille}}$$
Dosage par étalonnage
Spectre de la lumière blanche
Le spectre de la lumière blanche est continu avec des radiations comprises entre $380$ et $\rm 780~ nm$.
Absorbance
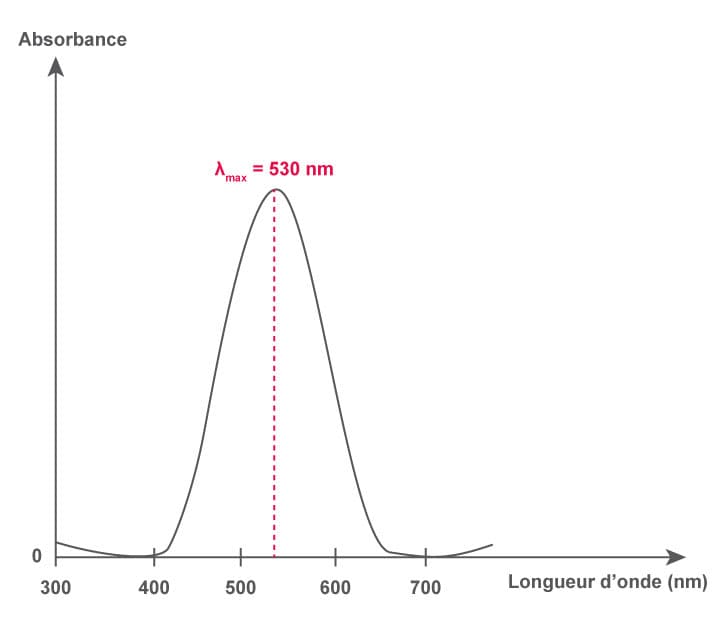
L'absorbance $\rm A$ (sans unité) d'une solution est une grandeur qui caractérise la capacité d'une solution colorée à absorber une partie de la lumière qui la traverse pour une longueur d'onde $\lambda$ donnée. On mesure l'absorbance $\rm A$ d'une solution à l'aide d'une cuve placée dans un spectrophotomètre. On mesure $\rm A$ pour chaque longueur d'onde du visible et on trace $\mathrm A = f(\lambda)$. On obtient par exemple :
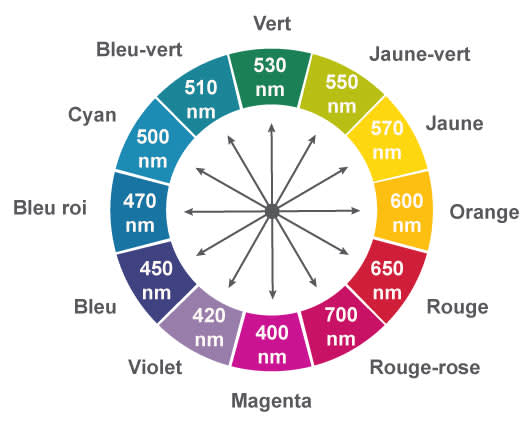
Le spectre d'absorption de la solution présente un maximum pour $\rm\lambda = 530~nm$. La couleur de la solution est donc la couleur complémentaire sur le cercle chromatique, soit magenta.
Loi de Beer-Lambert
Pour une longueur d'onde $\lambda$ donnée, l'absorbance d'une solution diluée de concentration $\rm C$ en espèce chimique colorée est donnée par la loi de Beer-Lambert :
$$\rm A = \epsilon \times \mathcal l \times C$$
avec :
- $\rm l$ : épaisseur de la solution traversée par la lumière en $\rm cm$
- $\epsilon$ : coefficient d'absorption molaire en $\rm L.mol^{-1}.cm^{-1}$
- $\rm C$ : en $\rm mol.L^{-1}$
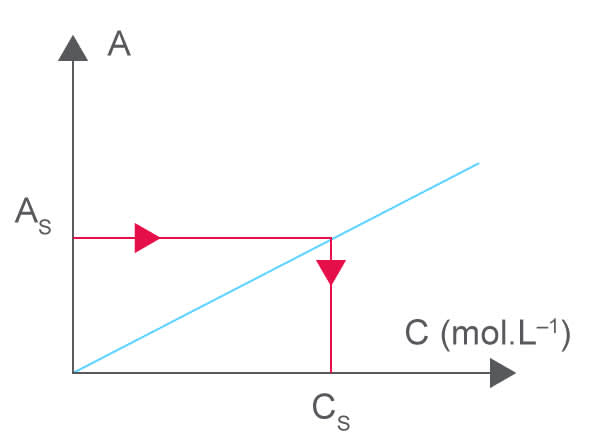
On écrit souvent $\mathrm A = k \times \rm C$ (relation de proportionnalité entre l'absorbance et la concentration d'une solution donc $\mathrm A = f(\rm C)$ donne une droite passant par l'origine.
Principe du dosage par étalonnage
Un dosage par étalonnage permet de déterminer la concentration en espèce chimique dans une solution en comparant son absorbance à celles de solutions étalons contenant la même espèce chimique et étant obtenues à partir de la dilution d'une solution mère de concentration connue. On mesure $\rm A$ de la gamme étalon obtenue, puis on trace $\mathrm A = f(\rm C)$. On mesure l'absorbance de la solution à doser. Grâce à la courbe d'étalonnage, on lit la concentration de l'espèce chimique.