La présence simultanée de l’espèce $\rm AH$ et de l’espèce $\rm A^-$ en solution aqueuse empêche le $\rm pH$ de varier sensiblement lors d’un ajout modéré d’acide fort ou de base forte, ou encore lors d’une dilution.
Une telle solution est appelée solution tampon.
En d’autres termes, si le $\rm pH$ d’une solution est tel que l’espèce $\rm AH$ et l’espèce $\rm A^-$ ont des concentrations non négligeables l’une par rapport à l’autre, on a une solution tampon.
Solution tampon :
Une solution tampon renferme un acide faible et sa base conjuguée en concentrations égales ou voisines.
On sait que $\rm pH = pK_A + \log \dfrac{[Base]}{[Acide]}$
Si $\rm [Base] = [Acide]$ alors $\rm pH = pK_A$.
Si $\rm [Base]$ est voisin de $\rm [Acide]$ alors $\rm pH$ est voisin de $\rm pK_A$.
Une solution tampon possède un $\color{red}{\rm pH}$ égal ou voisin du $\color{red}{\rm pK_A}$ du couple ayant servi à la préparer.
Le $\rm pH$ d'une solution tampon évolue peu :
- Par addition en quantité modérée d'acide
- Par addition en quantité modérée de base
- Par dilution limitée.
Effet tampon :
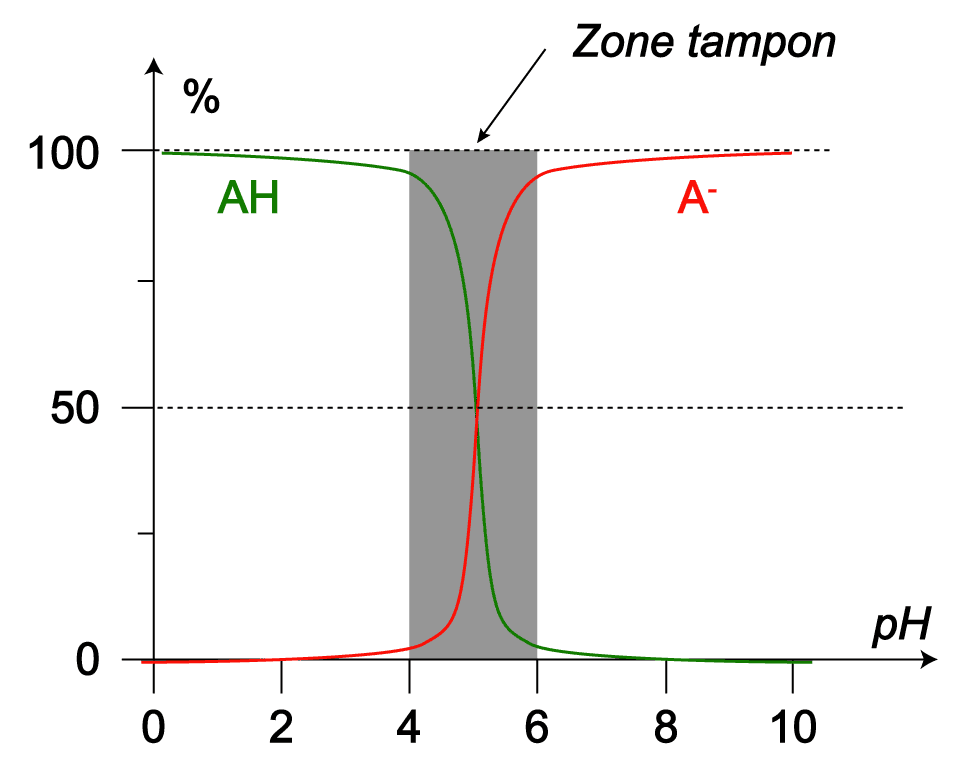
Exemple :
On considère $\rm AH/A^-$ dont le $\rm pK_A$ vaut $5,0$.
Si le $\rm pH$ de la solution aqueuse contenant ces espèces est compris entre $\rm 4,0(pK_A-1)$ et $\rm 6,0(pK_A + 1)$, alors la solutione est tampon.
Si le $\rm pH$ de la solution est supérieur à $6,0$ ou inférieur à $4,0$, une des deux espèces devient négligeable par rapport à l'autre et la solution n'est plus tampon.
La présence simultanée de l'espèce $\rm AH$ et de l'espèce $\rm A^-$ en solution aqueuse empêche le $\rm pH$ de varier sensiblement lors d'un ajout modéré d'acide fort ou de base forte, ou encore lors d'une dilution.
Une telle solution est appelée solution tampon.
En d'autres termes, si le $\rm pH$ d'une solution est tel que l'espèce $\rm AH$ et l'espèce $\rm A^-$ ont des concentrations non négligeables l'une par rapport à l'autre, on a une solution tampon.